NTRK基因融合的机制与靶向治疗
https://zhuanlan.zhihu.com/p/149104536
NTRK1于1982年被Mariano Barbacid团队在一次原癌基因的筛选实验中被发现,当时这项研究表明,TPM3-NTRK1融合蛋白具有很强的细胞转化能力从而促进肿瘤细胞的生长。1989年前后,研究人员陆续鉴定出TRK家族的三个成员TRKA、TRKB、TRKC。随后,TRK家族蛋白在不同的肿瘤中又被鉴定出多种多种融合形式。拉罗替尼是首个NTRK靶向药,于2018年11月获FDA加速批准上市,用于治疗携带NTRK基因融合的局部晚期或转移性实体瘤(不限癌种)。2019年8月,另一个不限癌种的NTRK靶向药恩曲替尼也被FDA加速批准上市。
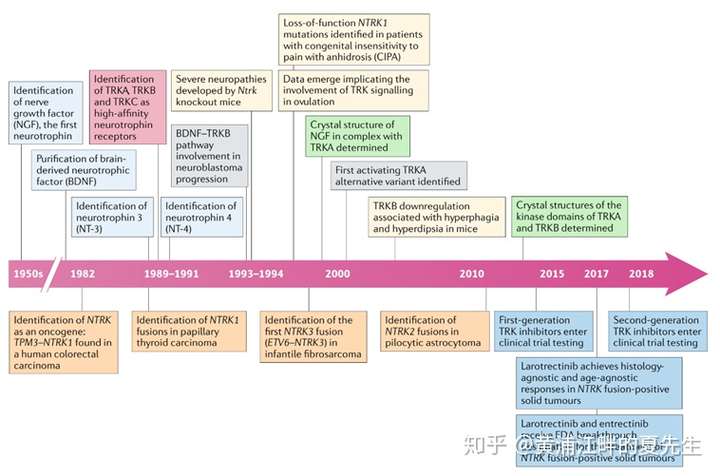
1. NTRK的结构与功能
TRK(tropomyosin-related kinase,原肌球蛋白相关激酶)蛋白是一类神经生长因子受体,属于酪氨酸激酶,TRK家族共包含3个高度同源的蛋白——TRKA、TRKB、TRKC,这三个蛋白分别由NTRK1、NTRK2和NTRK3基因编码。TRK与细胞增殖、分化、代谢、凋亡等密切相关。
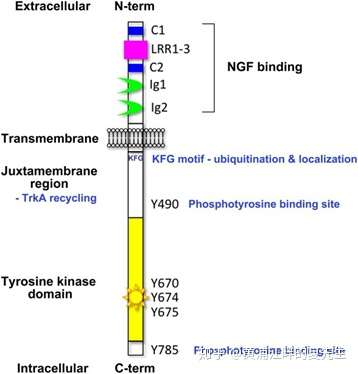
我们以TRKA为例来对TRK家族蛋白的结构进行说明。TRKA为跨膜蛋白,其胞外部分包含5个结构域,其中有两个胱氨酸富集区(Cysteinerich)C1和C2;C1和C2之间是亮氨酸富集区LRR;C3与跨膜区域之间有两个免疫球蛋白类似结构域Ig1和Ig2,其中Ig2为配体特异性识别的位点。TRKA的胞内部分主要为一个激酶催化结构域KD。TRKA的胞内部分有多个磷酸化位点,当TRKA二聚化之后会发生自磷酸化,先是Y676、Y680、Y681等位点发生磷酸化,上述位点的磷酸化又会使Y496、Y791两个位点发生磷酸化,从而激活TRK的激活活性。
目前已经鉴定出多种TRK的配体。TRKA的配体为NGF(neurotrophin nerve growth factor);TRKB的配体为BDNF(brain-derived neurotrophic factor)和NT-4(neurotrophin 4);TRKC的配体为NT-3(neurotrophin 3),如下图所示(这些配体本身也是二聚体,下图中的图示和标注均为二聚体的形式)。其中NT-3虽然也能和TRKA、TRKB结合,但是强度要弱于与TRKC的结合:
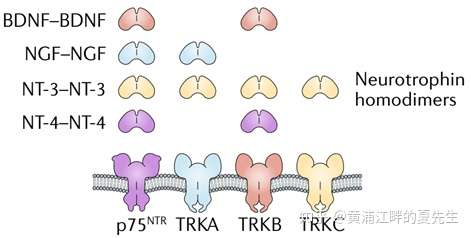
NTRK在中枢神经系统的发育过程中起到重要的作用。TrkA在交感神经、三叉神经、背根神经节、前脑和终脑皮层的胆碱能神经元中高度表达;TrkB在整个中枢神经和周围神经系统中都高度表达;而TrkC主要在哺乳动物的神经中枢组织中表达。Trk激酶受体在人体非神经组织中也广泛分布,如在唾液腺、胃、肠、胰腺、骨髓、肾上腺、前列腺、卵巢、子宫、骨髓肌等器官中都能发现TrkA或者TrkB的表达,TrkC与TrkA的分布模式类似,但是表达量比TrkA少很多;而在神经系统中,TrkC与TrkB的表达分布类似,所以,TrkC在神经类和非神经类组织中的表达有明显的差异。
2. TRK下游信号通路
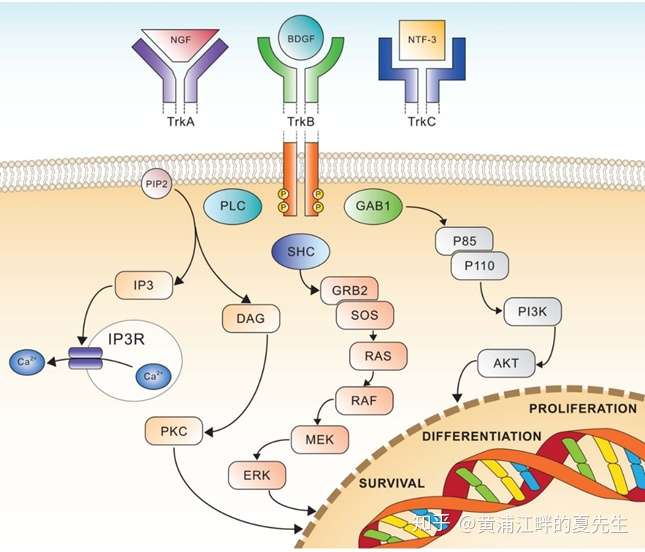
当TRKA、TRKB和TRKC与相应的配体相结合时,TRKs受体自身发生二聚化和磷酸化,进而激活下游多种信号通路包括MAPK通路、PI3K-AKT通路及PLCγ通路,最终参与细胞的增殖、分化和存活等生物学过程。正常情况下,TRKA参与人体痛觉的产生和维持,TRKB参与调节情绪和食欲方面,TRKC参与维持本体感觉神经的生理功能。
Ras/MAPK通路
当配体NGF与TrkA激酶结合后,连接蛋白SHC的SH2结构域与TrkA蛋白序列Y490位点结合,参与信号的传递。SHCGrb2结合,Grb2能够同时与SHC、鸟苷酸交换因子SOS结合形成SHC-Grb2-SOS复合物,SOS与受体或者受体底物蛋白上的酪氨酸磷酸化位点结合导致细胞质蛋白SOS向膜转位,并在小G蛋白Ras附近形成高浓度的SOS,SOS与Ras-GDP结合,促使GTP取代Ras上的GDP,使Ras由失活态转变为活化态,启动Ras通路。
PI3K/AKT通路
Gab能够介导PI3K-AKT信号的传递。PI3K能够催化磷脂酰肌醇(PI)生成磷脂酰肌醇-3,4二磷酸(PIP2)和磷脂酰肌醇-3,4,5三磷酸(PIP3),它们是细胞内重要的第二信使,将信号传递给下游蛋白,如AKT/PDK1。活化的AKT进一步激活下游的因子,如FoxO、TSC1/2、GSK3等,参与糖代谢、蛋白质代谢、脂肪代谢、细胞周期调节、细胞侵袭等一系列活动。
PLCγ通路
PLC-γ1作为NGF的触发因子,通过自身结构域SH2与TrkA激酶Y785氨基酸位点耦合来参与TrkA的膜转位和磷酸化激活。TrkA被激活后,PLC-γ1催化PIP2水解产生PIP3和二酯酰甘油(diacyl glycerol,DAG)两种分子作为第二信使。PIP3触发胞浆内钙离子释放,提高细胞内钙浓度,在激活PKC过程中与DAG起协同作用。DAG可激活蛋白激酶C(protein kinaseC,PKC),PKC可直接磷酸化Raf-1,参与不同细胞功能调节,如基因表达和细胞增殖、凋亡、迁移等。
3. NTRK融合与肿瘤靶向治疗
TRK信号通路的改变主要包括基因融合、蛋白过度表达、单核苷酸改变和剪接变异,其中NTRK基因的融合是最明确的致癌驱动因素。NTRK融合在多种肿瘤中都有发现,虽然在常见肿瘤肺癌、结直肠癌中的发病率低于5%,但该通路在各癌种致病中共享,并且其可以发生在身体的任何部位。就NTRK1/2/3基因发生融合的频率而言,在比较常见的恶性肿瘤如肺癌、CRC中NTRK基因融合的频率远低于5%,而在罕见的肿瘤类型如婴儿纤维肉瘤(infantile fibrosarcoma)、细胞型和混合型先天性中胚层肾病(Cellular and mixed congenital mesoblastic nephromad)、分泌型乳腺癌(secretory breast cancer,SBC)、涎腺乳腺样分泌癌(mammary analogue secretory carcinoma,MASC)中基因融合频率较高:
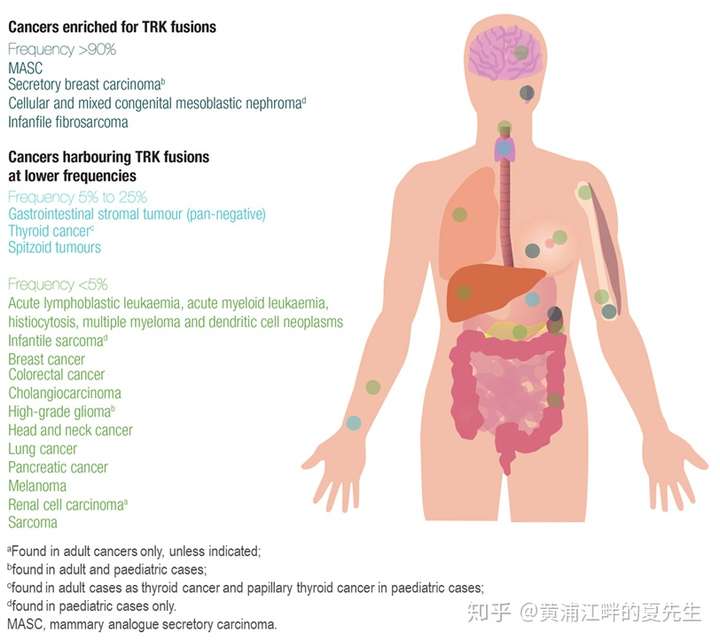
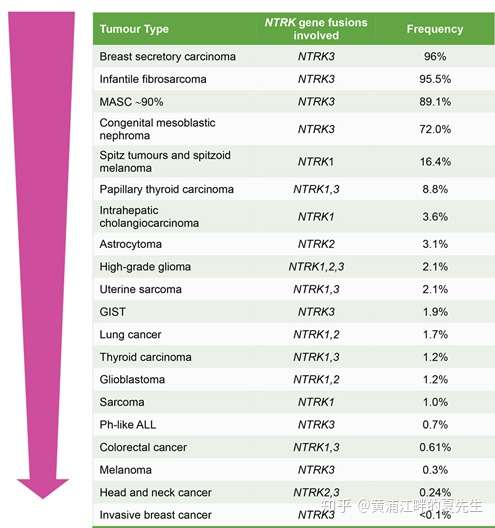
需要注意的是,NTRK1/2/3三个基因在不同的病种中发生融合的频率也是不同的。如上述NTRK融合概率较高的几种肿瘤中,发生融合的基因主要是NTRK3,而在NTRK融合频率较低的那些肿瘤中中的基因融合类型一般为NTRK1或NTRK3,NTRK2基因融合的发现较少。
目前共有2个NTRK靶向药物获批上市:恩曲替尼(Entrectinib)和拉罗替尼(Larotrectinib),属于第一代TRK抑制剂。恩曲替尼和拉罗替尼是继PD-1单抗药物Keytruda之后的两个只与基因分型有关而与肿瘤类型无关的"广谱"抗癌药物。
- 拉罗替尼:由拜耳和Loxo研发,于2018年11月27日该药全球首次获得美国食品与药物监督管理局(FDA)批准,用于治疗无已知耐药突变的、广泛转移或局部手术治疗效果不佳和经治疗后疾病进展或无替代治疗方案的NTRK基因融合的儿童和成人实体瘤患者。
- 恩曲替尼:恩曲替尼是NTRK1/2/3、ROS1和ALK的小分子抑制剂,由意大利Nerviano制药研发公司首先研制,后被罗氏所有。恩曲替尼于2019年相继在日本和美国上市,用于治疗NTRK融合和ROS1融合阳性患者。
这里需要着重说明一下,有些朋友把卡博替尼、瑞戈非尼等多靶点抑制剂也算作NTRK靶向药,这其实是十分外行的行为(如下表所示,这个表格是从一篇讲NTRK靶向药的文章中摘取的,注意这个表格是不对的)。诚然,卡博替尼、瑞戈非尼对NTRK确实是有一定的抑制效果,但这不代表它们就是NTRK融合的靶向药,也不代表“它们虽然没有被批准,但未来可能有希望被批准治疗NTRK融合的肿瘤”。
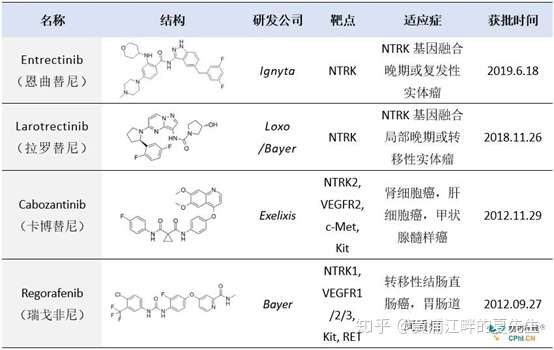
为什么卡博替尼、瑞戈非尼不是NTRK的靶向药呢?我找到了一篇2019年的论文(PMID30637364),就借着文中的数据来说明一下这个问题。下图中我们可以看到,卡博替尼cabozantinib对NTRK1/2/3的IC50值(半抑制浓度)分别为NA/7/NA(单位为nM),而一般能够成药的TKI要求其IC50应该不高于10nM。看到这里你应该明白了吧?卡博替尼只对NTRK2有抑制效果,对NTRK1和NTRK3没有抑制效果,因此这个药不管过了多久都不会获批治疗NTRK融合肿瘤的。瑞戈非尼regorafenib也是同理,它对NTRK1/2/3这三者的IC50分别为74、NA、NA,显然不能用来治疗NTRK融合的肿瘤。
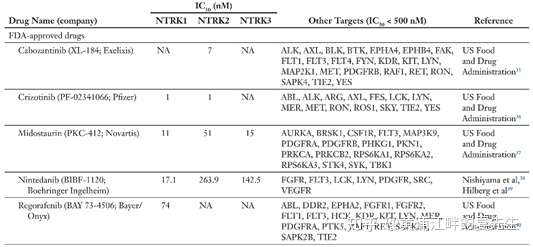
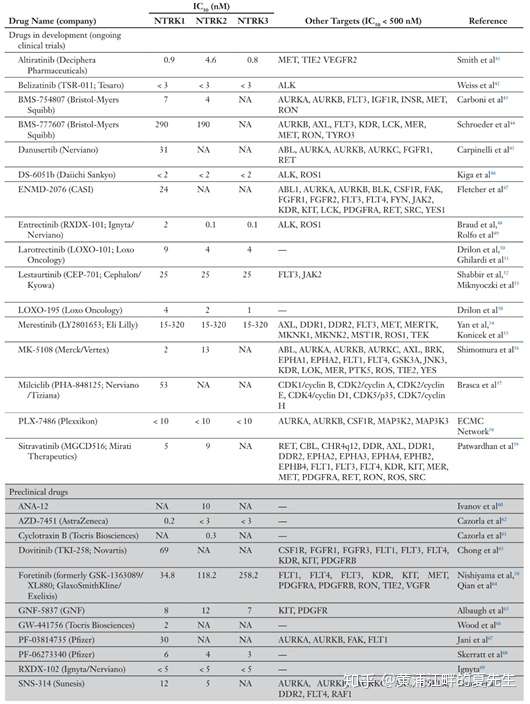
还是上面我提到的那篇2019年的论文,论文中我们可以看看其它上市/在研的一些药物(下表)。拉罗替尼对NTRK1/2/3的IC50分别为9/4/4nM,而恩曲替尼对NTRK1/2/3的IC50分别为2/0.1/0.1nM,从体外实验的角度看恩曲替尼是要好于拉罗替尼的。除了这两个药物以外,还有一些药物的IC50值满足成药的条件,比如Deciphera Pharmaceuticals的Altratinib(IC50为0.9/4.6/0.8nM)、第一三共的DS-6051b(IC50均小于2)、Loxo Oncology的Loxo-195(IC50分别为4/2/1nM)等药物,这些药物已经展开临床试验;临床前阶段的药物中也有几个有希望上市,,下面的表格基本上是比较全的,感兴趣的读者请自行阅读,这里就不列举了。
文章的最后,分别对已上市的拉罗替尼和恩曲替尼的基本信息进行简单的回顾。
拉罗替尼
拉罗替尼(larotrectinib,又称LOXO-101、ARRY-470和VITRAKVI®)是一种新型口服NTRK小分子抑制剂,由Loxo Oncology开发。FDA于2018年11月26日通过加速审批程序批准Vitrakvi用于用于治疗具有NTRK基因融合的成人和儿童局部晚期或转移性实体瘤,这是继帕博丽珠单抗2017年被FDA加速批准用于治疗高微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)的实体瘤之后批准的第2种不限癌种的药物,也是首个用于专门治疗NTRK融合肿瘤的药物。
对拉罗替尼疗效的评估是基于三个多中心、开放标签、单组的临床试验,治疗评价标准主要是测量总缓解率和缓解时间。使用高通量测序(NGS)或荧光原位杂交(FISH)确定具有NTRK基因融合的患有不可切除或转移性实体瘤患者55名,成人患者每天两次口服拉罗替尼100mg,儿科患者(18岁或更小)按体表100mg·m-2给药,最大剂量为100mg,每天两次。临床数据表明拉罗替尼对具有NTRK基因融合的不同类型实体瘤患者治疗总有效率为75%,其中完全缓解率为22%,部分缓解率为53%;73%的患者缓解时间在6个月以上,39%的患者缓解时间可持续一年以上。在2018年欧洲肿瘤医学会议上,Loxo Oncology公布的拉罗替尼治疗TRK融合癌患者的最新临床资料中,新报告的67例TRK融合患者总缓解率为81%,其中部分缓解率为63%,完全缓解率为17%,显示出良好的抗肿瘤活性。拉罗替尼最常见的不良反应(≥20%)是疲劳、恶心、头晕、呕吐、AST升高、咳嗽、ALT升高、便秘和腹泻。
恩曲替尼
恩曲替尼由意大利Nerviano制药研发公司首先研制。2013年10月与美国Ignyta制药公司签署协议,授权该公司独家经营权,进行产品开发及商业化。2017年10月22日,欧洲药品管理局(AME)凭借Ignyta制药公司所进行的3项Ⅰ期临床及一项Ⅱ期临床试验结果,对于既往曾接受过治疗,但病情进展或不能接受标准疗法的携带NTRK基因家族成员或原癌ROS1融合蛋白基因阳性、局部晚期或转移性实体瘤的儿科患者和成人患者服恩曲替尼胶囊所获得优异疗效,授予该产品优先级药物资格(Priority Medicine,PRIME)。2018年2月,美国Ignyta制药公司被瑞士罗氏(Roche)制药公司收购,成为其全资控股的子公司。2018年7月15日,罗氏公司与在日本控股的中外制药株式会社(Chugai)签订许可协议,授权中外制药在日本全权进行产品开发和上市申请。2019年6月18日恩曲替尼胶囊首次在日本获准上市,2019年8月15日获得美国FDA加速审批并上市,商品名为Rozlytrek®。
恩曲替尼本次获批基于一项关键II期STARTRK-2研究、I期STARTRK-1研究和I期ALKA-372-001研究,以及在儿童患者中开展的I/II期STARTRK-NG研究的一系列临床试验的数据。STARTRK-2研究结果显示,携带NTRK1/2/3-ROS1或ALK基因融合实体瘤患者接受Entrectinib治疗的客观应答率(ORR)为56.9%,在10种不同类型的肿瘤(不管基线时是否有脑转移)中都观察到肿瘤缩小,中位的应答持续时间为10.4个月(次要终点)。对于发生脑转移的患者,Entrectinib的颅内ORR也有50%。